Es klingt wie der Plot aus einer Episode von Scrubs – Die Anfänger. Eine Frau wird im Urlaub mit Tollwut infiziert. Monate später liefert man sie ins Krankenhaus ein. Aufgrund ihrer Drogenvergangenheit wird eine Überdosis vermutet. Sie stirbt an Herzversagen. Nach ihrem Tod werden ihre Organe entnommen und transplantiert. Beinahe alle Transplantationspatienten erkranken an Tollwut und versterben. Doch genau das ist im Jahre 2004 hier in Deutschland passiert.
Schaut man sich das Rabies-Bulletin der WHO an, so muss man für Deutschland bis ins Jahr 2007 zurückgehen, um den letzten Menschen zu finden, der hierzulande mit Tollwut infiziert war. Seither haben sich gemäß diesen Aufzeichnungen lediglich 4 domestizierte Tiere infiziert. Alle übrigen Fälle belaufen sich auf Fledermäuse, die im Rahmen von Surveillance-Maßnahmen gefunden werden. Die Terrestrische Tollwut, also die Tollwut, die durch Tiere wie Hunde und Füchse übertragen wird, gilt dank umfangreicher Impfmaßnahmen (z.B. Impfköder für Füchse) in Deutschland als ausgerottet.
Und hier sind wir auch schon mitten in der Geschichte. Denn während man sich in Deutschland und dem europäischen Westen relativ gefahrlos bewegen kann, stellt die Tollwut andere Regionen, wie Osteuropa, Asien und Afrika vor große Probleme. Nehmen wir Indien als Beispiel. 36% aller gemeldeten Tollwutfälle ereignen sich hier. Jährlich sterben über 20000 Menschen an Tollwut. Die genaue Opferzahl ist schwer abzuschätzen, da lediglich gemeldete Fälle registriert werden und Dunkelziffern per Definition eher suboptimal erfasst werden können. Lediglich der Überträger ist ausgemacht: Hunde. Die Infektion von Menschen findet quasi ausschließlich über die Bisse infizierter Hunde statt.
Genau so hat sich unsere Patientin im Jahr 2004 infiziert. Während eines Aufenthalts in Indien wurde sie von einem tollwütigen Hund gebissen. In Ermangelung eines minutiösen Berichts zeichnen wir also einen hypothetischen Infektionsverlauf nach:
Der Biss
Die Zähne des Hundes durchdringen die Haut. Der Speichel des Tieres, der mit den Tollwut- oder auch Rabiesviren gespickt ist, hat somit freien Zugang zu Muskel- und Nervenfasern, entlang derer es sich ausbreitet. Die Viren halten sich in den Wundrändern und dem umliegenden Gewebe für den Großteil der Inkubationszeit auf, wo sie sich vermehren, bevor sie ihren Weg ins zentrale Nervensystem antreten. Diese Inkubationszeit kann zwischen einigen Tagen und mehreren Monaten variieren. Je nach dem, wie weit der Biss vom Rückenmark entfernt ist. Bis zur Ausprägung der ersten Symptome verheilt die Bisswunde meist. So wohl auch bei unserer Patientin. Doch die Viren können sich in der Zwischenzeit ungehindert in den Muskelzellen vermehren.
Um genau das zu verhindern, ist der erste Schritt nach einem Biss, die Wunde lange und ausgiebig zu spülen, um möglichst viele Erreger auszuwaschen. Auch der Einsatz antiviraler Flüssigkeiten (z.B. Jodtinkturen) wird empfohlen.
Die unmittelbare Wundversorgung reduziert das Infektionsrisiko, ist aber auf keinen Fall ein Ersatz für das, was nun folgen muss. Die Postexpositionsprophylaxe (PEP). Hierbei ist der rechtzeitige Beginn entscheidend. Mit der PEP sollte unmittelbar nach dem Kontakt begonnen werden, wenn auch nur der Verdacht auf eine Tollwutinfektion besteht. Im Rahmen dieser PEP erfolgt eine Reinigung der Wunde und eine Injektion von Rabies-Immunglobulinen in die Wunde, sowie in die Wundränder. Immunglobuline sind Antikörper, die sich explizit an das Rabiesvirus heften und so die Ausbreitung des Virus hemmen, bis das Immunsystem aktiv wird. Die Gabe dieser Immunglobuline erfolgt nur bei Personen, die immunologisch naiv sind, also noch nicht gegen Tollwut geimpft wurden. Unabhängig von dieser Injektion werden nun im Verlauf von etwa 4 Wochen eine Reihe von Injektionen mit einem Tollwutimpfstoff durchgeführt. Die genaue Zahl der Injektionen richtet sich nach der Antikörperkonzentration (dem Titer) im Blut. Ziel ist es, diesen auf 0.5 IE/ml anzuheben. Wird diese PEP zeitnah und fachgerecht durchgeführt, ist sie bei ansonsten gesunden Patienten zu beinahe 100% wirksam.
Aber was, wenn die Prophylaxe nicht wirksam ist oder gar nicht erst durchgeführt wird?
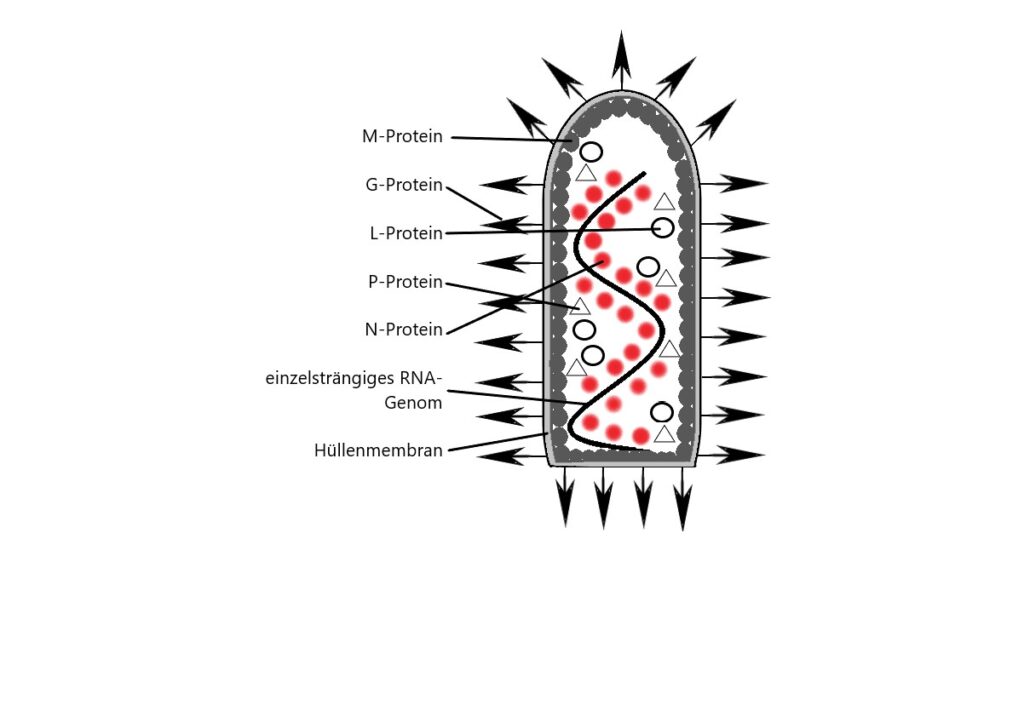
Das Nucleotidprotein (N) umhüllt die RNA, das Phosphoprotein (P) ist ein Cofaktor des L-Proteins und hat regulatorische Funktionen, die Matrix (M) spielt ebenfalls regulatorisch eine Rolle und sorgt dafür, dass das Nucleoprotein kondensiert, das Glycoprotein (G) wird zum Andocken an Wirtszellen verwendet und das Large Structural Protein (L) ist eine RNA-Replicase
Die Ausbreitung des Virus
Um in Zellen eindringen zu können, müssen Viren ein Protein, ein Lipid oder irgendeinen anderen Rezeptor auf der Zelloberfläche finden, an den sie binden können. In den Muskelzellen verwendet das Rabiesvirus den nikotinischen Acetylcholinrezeptor nACR. Diese Rezeptoren sind Ionenkanäle, die auf den Neurotransmitter Acetylcholin reagieren, aber auch von nikotinergen (also nikotinähnlichen) Substanzen aktiviert werden können. Im Körper dienen sie normalerweise der Reizweiterleitung von den Nervenzellen zur Muskulatur. Das Virus scheint auch andere Rezeptoren zum Eindringen in die Muskelzellen zu verwenden, aber eine Erwähnung aller potenziellen Rezeptoren würde zu weit führen.
Nachdem sich ausreichend Viren in der Muskulatur gebildet haben, wandern sie zur neuromuskulären Endplatte, der Verbindung zwischen Muskeln und Nerven und beginnen mit ihrer Ausbreitung durch die Nervenbahnen.
Der Momentan wahrscheinlichste Kandidat, der die Weiterleitung des Virus durch die Nervenzellen hin zum Gehirn ermöglicht, ist das Glykoprotein CD56, das auch als NCAM (neural cell adhesion molecule) bekannt ist. Einfach gesagt, spielt dieser Rezeptor eine Rolle bei der Bildung von Nervenzellen und der Signalübertragung zwischen diesen. Gezeigt werden konnte der Einfluss von NCAM in Zellkulturen, indem man die Produktion des Proteins in der Zelle steigerte, wodurch die betroffenen Zellen anfälliger für das Eindringen des Rabiesvirus wurden. Durch diese Wanderung entlang der Nervenzellen kann das Virus auch die Blut-Hirn-Schranke umgehen.
Verantwortlich für die Bindung an die zellulären Rezeptoren sind die G-Proteine, die auf der Virenhülle sitzen. Hat das Virus an einem Molekül auf der Membranoberfläche einer Nervenzelle gebunden, wird die Konformität des G-Proteins verändert, was eine Verschmelzung der Kapsel des Virus und der Zellmembran ermöglicht, wodurch das Virus sein Erbgut ins Innere der Zelle schleust, wo es sich selbst repliziert. Wer es genauer wissen möchte: Über eine ATP-abhängige Ionenpumpe wird das Innere des Vesikels angesäuert. Dies führt zur Änderung der Konformation des G-Proteins und aktiviert seine Fusionsaktivität. Über die Verschmelzung der Membranen gelangt das Nucleocapsid in das Cytoplasma. Mit dem Nucleocapsid sind weitere Proteine des Virus komplexiert, die anschließend die Transkription des RNA-Genoms triggern.
Nachdem das Virus eine Zelle entert, reagiert das Protein RIG-1 auf die fremde RNA und setzt eine Signalkaskade in Gang, die zur Ausschüttung von Zytokinen führt. Zytokine sind eine Gruppe von Proteinen und Peptiden, die eine Vielzahl von Aufgaben im Immunsystem übernehmen und – vereinfacht gesagt – die Immunantwort steuern. Diese unmittelbare Immunantwort ist nicht ausreichend für die komplette Entfernung des Virus, und die späte Produktion von Antikörpern lässt darauf schließen, dass die Zahl der Viren, die bei einem Biss übertragen werden, zu gering ist, um eine Antwort der T- und B-Zellen auszulösen. Wer also nicht bereits geimpft ist, wird kaum neutralisierende Antikörper produzieren, bevor das Virus im Spinalkanal landet und den Weg ins Gehirn antritt. Das P-Protein des Tollwutvirus interferiert mit den STAT1-Proteinen, was wohl letztendlich die Reifung von B-Zellen verhindert. Zumindest temporär, denn irgendwann wird die Virenlast zu groß und B-Zellen werden aktiv.
Nach diesem Muster wandert das Virus nun Stück für Stück die Nervenbahnen entlang, bis es letztendlich das Gehirn erreicht. In der Literatur schwanken die genauen Angaben der zurückgelegten Strecke des Virus zwischen einigen Millimetern und bis zu 20 cm pro Tag. Im Gehirn vermehrt es sich in der grauen Substanz weiter und wird nach einigen Tagen wieder über die Nervenzellen im gesamten Körper verteilt.
Aber dieses ominöse G-Protein, das sich auf den Viruszellen findet, hat noch andere Funktionen. Zum Beispiel ist es das primäre Ziel des Tollwut-Impfstoffes. Denn auf dem G-Protein befinden sich zwei Epitope, an denen Antigene binden können, die so das Virus neutralisieren, indem sie das Eindringen in die Zelle verhindern. Und genau dieser Umstand hat einem der Transplantationspatienten das Leben gerettet. Er erhielt das Lebertransplantat, wurde aber etwa 20 Jahre früher gegen Tollwut geimpft und hat die Erkrankung dadurch überlebt.
www.scientificanimations.com/wiki-images/, CC BY-SA 4.0, via Wikimedia Commons
Der Tollwut-Impfstoff
Der erste Impfstoff gegen Tollwut feiert im Jahr 2025 bereits seinen 140. Geburtstag. Am 6. Juli 1885 wurde Joseph Meister als erster Mensch gegen die Tollwut geimpft. Er wurde in von einem tollwütigen Hund insgesamt 14 Mal in Hände und Oberschenkel gebissen. Erfinder des Impfstoffes war Louis Pasteur, der aufbauend auf der Arbeit von Georg Gottfried Zinke tollwütige Kaninchen verwendet hat, um durch fortlaufende Passagierung ein Impfvirus zu entwickeln. Verimpft wurden Zellen aus dem Rückenmark infizierter Kaninchen, die zerrieben und anschließend zwei Wochen getrocknet wurden. Die darauffolgenden Impfdosen wurden für immer kürzere Zeitspannen „inaktiviert“, bis am Ende der Impfserie quasi lebende Viren injiziert wurden. Dieselbe Impfung erhielt wenige Wochen später der 14-jährige Jean Baptiste Jupille, der von einem tollwütigen Hund gebissen wurde, nachdem er versuchte, andere Kinder vor dem Angriff dieses Hundes zu schützen. Beide Kinder erkrankten trotz der Bisswunden nicht an Tollwut. Pasteur sah sich allerdings massiven Anfeindungen und Ablehnung durch die Bevölkerung ausgesetzt, die einen Impfstoff, der auf lebenden Viren basierte, als „medizinische Morde“ ansah. Und ungerechtfertigt waren diese Vorwürfe nicht. Bevor die beiden Jungs geimpft wurden, konnte Pasteur keine wirklichen Erfolge seines Impfstoffes vorweisen. Zudem verfügte Pasteur nicht über dieselben Möglichkeiten, Viren zu inaktivieren, die wir heute haben. Das eröffnete damals die Möglichkeit einer Infektion mit Tollwut, durch nicht ausreichend inaktivierte Impfstoffe. Erst nachdem Pasteur nachweisen konnte, dass mehrere Dutzend Menschen und Tiere erfolgreich mit seiner Impfroutine geimpft werden konnten, begann die Opposition gegen den Impfstoff abzunehmen.
Die Impfung von Joseph Meister stellt trotz allem den Durchbruch zur Zähmung einer jahrtausendealten Plage dar. Die Tollwut wurde als Krankheit bereits rund 2300 Jahre vor Christus im babylonischen Gesetzbuch ‚Eshnunna‘ beschrieben. So mussten damals Hundehalter, deren Hunde Menschen mit Tollwut infizieren (sprich: Töten), mit einer Geldstrafe rechnen.
Eine der ersten Behandlungsempfehlungen nach Bissen von tollwütigen Hunden finden wir in den Schriften von Aulus Cornelius Celsus, der schon im ersten Jahrhundert vor Christus empfahl, die Bisswunden auszubrennen oder großflächig wegzuschneiden. Eine weniger gewalttätige Version dieser Idee findet sich noch heute in der Wundbehandlung. Wir gehen nur dazu über, die Wunde auszuspülen und mittels Postexpositionsprophylaxe zu behandeln.
Die letzte große Entwicklung in Sachen Tollwutimpfung stammt aus dem Jahr 1980. Seit damals finden Impfstoffe Verwendung, die aus in vitro gezüchteten und abgetöteten Tollwutviren bestehen. Ein solcher Impfstoff ist RabAvert, dessen Impfvirus durch 59-fache Passage des Virus in Hühnereiern gezüchtet wurde. Dies sorgt dafür, dass das Virus sich auf die Zellen der Eier einstellt und so eine geringere Affinität für andere Wirte zeigt. Die eigentliche Vermehrung des Virus findet in einem synthetischen Zellkulturmedium statt, zur Inaktivierung wird Beta-Propiolacton verwendet. Als Stabilisatoren werden Albumin und Polygelin verwendet, sowie Antibiotika um unerwünschtes bakterielles Wachstum zu verhindern.
Die Impfung gegen Tollwut führt zu einer starken B-Zell-Antwort insbesondere auf das virale G-Protein. Die Impfstoffinduktion der Tollwut-Antikörper erfordert die Hilfe von CD4+ T-Zellen, die durch inaktivierte Tollwutimpfstoffe stimuliert werden. Anfangs erfolgen die Reaktionen durch T-Helferzellen -unabhängige kurzlebige Plasmazellen – gefolgt von langfristigen Plasmazellen, die affinitätsmodifizierte Antikörper produzieren. Die Tollwutimpfung induziert auch die Bildung von Gedächtnis-B-Zellen, die lange bestehen bleiben und auch Jahrzehnte nach einer erfolgten Impfung wieder aktiviert werden können. Zudem werden CD8+ T-Zellen, die – laut Studien an Mäusen – nicht zum Schutz gegen das Tollwutvirus beitragen, durch aktuelle menschliche Tollwutimpfstoffe nicht induziert. [1]
Aber auch wenn die Erfolge des Tollwut-Impfstoffes, sowie der PEP ohne Zweifel auf der Hand liegen, darf nicht unerwähnt bleiben, dass der Mensch ohnehin wenig anfällig für Tollwut ist. Zumindest im Vergleich zu anderen Säugetieren wie Füchsen, Waschbären und Wölfen. Nur etwa 15% der Bisse führen beim Menschen unbehandelt zum Tod [2]. Es scheint also nicht immer zu einer Etablierung des Virus im Gewebe zu kommen. Man erkennt eine Korrelation zwischen der Entfernung der Bisswunde zum Gehirn und der Inkubationszeit. Viren, die durch Wunden an den Extremitäten eindringen, benötigen mehr Zeit, um das Gehirn zu erreichen, als bei Wunden im Bereich des Gesichts oder Torsos. Bei Verletzungen an den Extremitäten scheint es also eine größere Wahrscheinlichkeit zu geben, dass das Immunsystem den Erreger erfolgreich bekämpfen kann. Die einzige Ausnahme stellen hier die Hände dar, die aufgrund der vielen vorhandenen Nervenzellen ebenfalls eine schnelle Ausbreitung des Virus ermöglichen. Natürlich spielen neben der Entfernung auch andere Faktoren, wie die beim Biss übertragene Virusmenge, sowie die Infektiosität des Virus eine Rolle.[2]
Interessant ist hier auch, dass man besonders bei Menschen, die regelmäßig Kontakt mit wilden Tieren haben, Antikörper gegen die Tollwut findet. Diese Antikörper fand man u.a. bei den Jägern eines kanadischen Inuit-Stammes, Waschbärjägern in Florida oder Bewohnern der peruanischen Amazonasregion. Der Kontakt mit dem Erreger findet vermutlich über die Luft statt, wenn infizierte Tiere den Erreger als Aerosol ausatmen. Auch der Kontakt mit infizierten Speichelresten auf dem Fell der Tiere kann zur Übertragung des Virus führen. Vermutlich ist die Virusmenge und der Weg über die Lunge für eine Infektion nicht ausreichend.
Die Symptome
Definitiv ausreichend für eine Infektion sind aber die Viren, die man auf den transplantierten Organen unserer Tollwutpatientin findet. Denn bei einer Transplantation wird nicht nur der Körper massiv beansprucht, es werden auch alle Schutzmechanismen des Körpers umgangen, das Virus hat direkten Zugang zur Blutbahn. Und genau dieser Umstand hat die Transplantatempfänger das Leben gekostet.
Was passiert nach der Infektion?
Alle ungeimpften Patienten sterben an Tollwut, sobald die ersten Symptome ausbrechen. Vielen bleiben nach dem Ausbruch nur Tage. Vielleicht 2-3 Wochen. Für viele Erkrankte handelt es sich beim ersten Symptom um Schluckbeschwerden. Das Virus richtet im Gehirn massive Schäden an und beeinflusst auch den Nucleus ambiguus, eine Ansammlung von Nervenzellen in der Medulla oblongata, einem Teil des Hirnstamms. Diese gestörte Reizweiterleitung der Nervenzellen führt beim Schlucken zu Kontraktionen des Diaphragmas. Diese Spasmen dauern nur einige Sekunden an, können aber schlimmstenfalls von massiven Kontraktionen der Nackenmuskulatur, Krampfanfällen oder Erbrechen begleitet werden. Diese Krampfanfälle können so massiv sein, dass sie unbehandelt zu einem Herzstillstand führen. Die Patienten versuchen also alles, um das Schlucken zu vermeiden. Sie dehydrieren sich absichtlich, schlucken ihren Speichel nicht mehr (was gemeinsam mit einer Überproduktion des Speichels zum augenscheinlichen Schaum vorm Mund führt), und reagieren zunehmend abwehrend bis panisch auf die alleinige Erwähnung von Flüssigkeiten. Von dem Geräusch, das von fließendem Wasser verursacht wird, ganz zu schweigen.
Und wo die Hydrophobie existiert, ist die Aerophobie nicht weit. Die Angst vor Luft. Denn selbst das Registrieren eines Lufthauches auf der Haut kann bei Tollwutpatienten zu schweren Spasmen führen. Ein häufiger Tollwuttest besteht darin, mit einem Fächer Luft über das Gesicht von Patienten zu wehen, und zu beobachten, ob der Körper daraufhin Spasmen zeigt.
Während sich Virus im Gehirn ausbreitet, nehmen die neurologischen Symptome zu. Die Bandbreite reicht hier von Verwirrtheit, Angst, Halluzinationen oder Schlaflosigkeit, bis zum Delirium. Bekannte Symptome umfassen sowohl kurze Phasen der Hyperaktivität und Aggressivität, als auch einsetzende Photophobie, also Angst vor Licht.
Diese sogenannte enzephalopathische Tollwut tritt häufig bei Menschen auf, die von tollwütigen Hunden gebissen wurden. Wer durch Kontakt mit infizierten Fledermäusen eine Tollwut entwickelt, oder bei wem die Postexpositionsprophylaxe nicht anschlägt, zeigt häufiger Symptome der paralytischen Tollwut. Diese verläuft weniger aggressiv und zeichnet sich in erster Linie durch den Verlust von Muskelkraft aus, die in den Extremitäten beginnt und langsam den gesamten Körper erfasst. Das Gehirn wird hierbei nicht so schnell zerstört, wie bei der enzephalopathischen Tollwut.
Die weitere Ausprägung der Symptome ist von Fall zu Fall unterschiedlich. Aber sie lassen sich so zusammenfassen: Das Gehirn verliert die Fähigkeit den Körper zu steuern.
Die Körpertemperatur steigt oder fällt über das Normalmaß hinaus, das Herz schlägt unregelmäßig bis hin zur Tachykardie, die Sauerstoffkonzentration im Blut nimmt ab, was teilweise durch eine einsetzende Atemdepression bedingt ist. Dazu kommen stellenweise Einblutungen in den Gastrointestinaltrakt, also den Verdauungsapparat, die zum Erbrechen von Blut führen können. Das endokrine System, also der Hormonhaushalt des Körpers funktioniert ebenfalls nicht mehr ordnungsgemäß und die Patienten, die es auf eine gut ausgestattete Intensivstation geschafft haben, sterben nun häufig an Multiorganversagen. Vorausgesetzt, das Herz hält so lange durch. Viele dieser Symptome wurden auch von der tragischen Figur dieses Textes exprimiert:
Nachdem unsere spätere Organspenderin im Oktober 2004 in Indien von einem Hund gebissen wurde, blieb auch sie bis zum Dezember desselben Jahres symptomfrei. Eine Woche vor ihrem Tod begannen die Symptome in Form von Kopfschmerzen, Fieber und aggressivem Verhalten. Ein Kokaintest war positiv, es gab keinen Vermerk über einen Hundebiss und aus diesem Grund wurde eine toxische Psychose als Grund für ihre Wesensveränderung angenommen. Als Organspenderin wurden ihr daraufhin Lunge, Nieren, Pankreas, Leber und Hornhäute entnommen. Beispielhaft ist hier der Krankheitsverlauf der Lungenempfängerin geschildert. Neben dem Patienten, der das Lebertransplantat erhalten hat, hat auch die Patientin überlebt, der die Hornhäute transplantiert wurden. Die Labordiagnostik zeigte keinen viralen Befall, zur Sicherheit wurden die Transplantate aber dennoch wieder entfernt.
Labordiagnostik
Nun stellt sich die Frage, wie eine Krankheit, die so viele massive Symptome verursacht, den Ärzten entgehen konnte, die für die Vorbereitung und Durchführung der Organtransplantationen verantwortlich waren. Sollte so eine Krankheit nicht problemlos zu detektieren sein?
Kurzgesagt: Nein.
Sollte man das Gehirn mittels CT oder MRT untersuchen, so findet man häufig nur unspezifische Entzündungszeichen, in frühen Phasen der Erkrankung lassen sich teilweise überhaupt keine Symptome finden. Die Viren vermehren sich zwar im Gehirn, verursachen im Anfangsstadium aber nur geringe Schäden an den Hirnzellen. Da der Körper zudem einige Tage benötigt, um gegen das Virus Antikörper zu produzieren, sind diese Antigentests häufig erst in der 2. Woche der Erkrankung aussagekräftig.
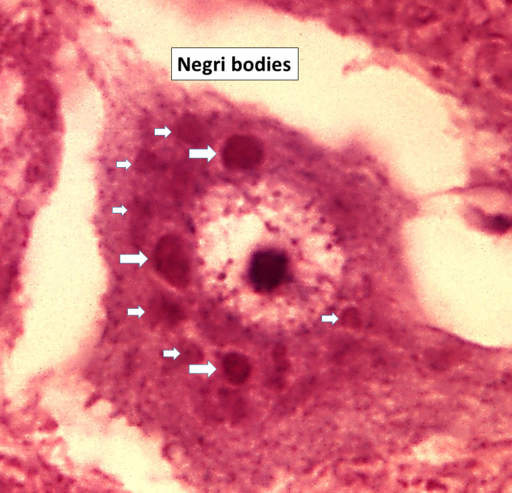
Die vielversprechendste Möglichkeit für den Nachweis der Tollwut besteht in der Entnahme von Proben der Haut oder der Rückenmarkflüssigkeit, die mittels TaqMan-PCR analysiert werden. Bei unmittelbarem Verdacht auf eine Tollwutinfektion kann sowohl ante- als auch post mortem eine Hirnbiopsie vorgenommen werden. Das Gewebe sollte sowohl auf das Vorhandensein von viraler RNA oder Antigenen, als auch auf das Vorhandensein von Viren (z.B. indirekt durch Anzucht in Kulturen mit BHK-Zellen) untersucht werden. Ein deutliches – aber nicht immer vorhandenes – Zeichen von Tollwut sind die sogenannten Negri-Körperchen. Diese sind Einschlusskörper im Cytoplasma von Nervenzellen, die im Spätstadium der Tollwut auftauchen und in erster Linie aus dem Kapsel- und Phosphoprotein des Virus bestehen. Man findet sie besonders in den Pyramidenzellen des Hippocampus, im Hirnstamm und in Hautzellen des Nackens. In den Negri-Körperchen findet auch die Replikation des Virus statt. Nach Anfärbung des Präparats lassen sich die Einschlüsse deutlich darstellen:
Gibt es wirksame Therapien gegen die Tollwut?
Die Aussage, dass jeder Mensch an Tollwut stirbt, sobald die Symptome auftreten, ist in dieser Form eigentlich nicht korrekt. In der Literatur werden immer wieder Fälle beschrieben, bei denen Menschen eine Erkrankung überleben. Häufig erhalten sie eine Postexpositionsprophylaxe, die das Einsetzen der Symptome nicht verhindern kann, aber in Kombination mit Intensivmedizinischen Maßnahmen das Überleben ermöglicht. Allerdings mit teils massiven Folgeerkrankungen. Hier sind einige Beispiele:
In den USA wurde 1970 ein sechsjähriger Junge von einer Fledermaus in den Finger gebissen. Bei der Fledermaus wurde die Tollwut nachgewiesen, beim Patienten wurde bis zuletzt kein Erregernachweis durchgeführt. Auch Negri-Körperchen wurden nicht festgestellt. Der Junge erhielt im Verlauf von 14 Tagen insgesamt 15 Impfungen mit einem Tollwutimpfstoff, der aus Entenembryonen gewonnen wurde. 2 Tage nachdem er diese Impfserie beendet hatte (insgesamt 20 Tage nach dem Biss), begannen die Symptome, die klinisch zur Tollwut passten. Die Symptome begannen mit Nackenschmerzen und Fieber. Seine Muskelkraft nahm zusehends ab, er wurde in ein künstliches Koma versetzt und es musste eine Tracheotomie durchgeführt werden, um ihn zu beatmen. 19 Tage nach seiner Einlieferung ins Krankenhaus wurde er aus dem künstlichen Koma geholt und seine Symptome begannen, sich zurückzubilden. Er konnte vollständig genesen. Ob er wirklich an der Tollwut erkrankte, lässt sich nicht abschließend sagen, die Diagnose wurde als Ausschlussdiagnose und aufgrund des positiven Erregernachweises der Fledermaus gestellt.
1992 wurde ein neunjähriger Junge in Mexiko von einem tollwütigen Hund mehrfach ins Gesicht gebissen. Die Infektion des Hundes wurde nachgewiesen. Die Bisswunde wurde gespült und der Junge erhielt eine Serie von Impfungen am 1., 3., 7., 14. und 30. Tag nach der Infektion. Etwa 3 Wochen nach der Infektion begannen die Symptome mit Fieber und Schluckbeschwerden. Die Symptomschwere nahm zu, es kam zu Krampfanfällen und Zeichen einer Enzephalitis. 21 Tage nach seiner Einweisung ins Krankenhaus wurde ebenfalls eine Tracheotomie durchgeführt. Der Nachweis einer Infektion des Jungen erfolgte über eine Ausschlussdiagnostik, sowie über den Nachweis von Antikörpern im Liquor. Nach Abklingen der Symptome blieb der Junge vom Hals abwärts vollständig gelähmt, obwohl sich zum Zeitpunkt des Fallberichts (2 Jahre nach der Infektion) eine leichte Besserung einstellte. Während der Erkrankung entwickelte sich eine Amaurose, eine vollständige Erblindung. Der Patient erlangte die Fähigkeit zurück, Nahrung selbstständig zu schlucken. Allerdings verstarb er weniger als 4 Jahre nach der Infektion (Tabelle 1, Fußnote b).
Ein weiterer Fallbericht handelt von einem Jungen, der viereinhalb Jahre nach seiner Infektion vorstellig wurde. 2010 erlitt er durch einen Hund Bisswunden im Gesicht. Er erhielt ein Immunglobulin, sowie 4 Impfdosen. 25 Tage nach dem Biss begannen die Symptome mit Fieber und Krampfanfällen. Es wurde eine Enzephalomyelitis diagnostiziert. Aufgrund der fachgemäß erfolgten Postexpositionsprophylaxe ging man nicht von einer Tollwutinfektion aus. Die Symptome verschlechterten sich, der Patient wurde für fast 50 Tage künstlich beatmet. 2 Jahre nach Krankheitsbeginn wurden Gewebeproben des Patienten mittels PCR und FAT untersucht. Es konnte noch immer virale RNA nachgewiesen werden. Insgesamt 4 Jahre nach der Erkrankung konnte der Patient noch immer nicht auf Ansprache reagieren, öffnete nur sporadisch die Augen. Er litt weiterhin unter Krampfanfällen, neurologischen Auffälligkeiten im MRT und der RNA-Nachweis mittels TaqMan-PCR fiel im Nackengewebe ebenfalls noch positiv aus. 5 Jahre nach der Infektion erklärte der Vater, der Junge sei noch immer bettlägerig, litt unter regelmäßigen Krampfanfällen und sei rund um die Uhr auf Pflege angewiesen.
Es gibt vielleicht ein, höchstens zwei Dutzend anderer Fälle, die in der Literatur beschrieben werden. Bei quasi allen Fällen erfolgt die Diagnose über den Tollwutnachweis beim Tier, dem Ausschluss anderer Krankheiten, sowie einem Anstieg der Antikörperlevel im Liquor, die sich nicht über die verwendete Impfung erklären lassen. Natürlich bleibt hier immer die Frage, ob auch alle Patienten an Tollwut erkrankten.
Lange Zeit setzte man die Hoffnung in das sogenannte Milwaukee-Protokoll, bei dem die Patienten in ein künstliches Koma versetzt werden, während man sie mit Ketamin (einem Betäubungsmittel), Ribavirin (einem Virostatikum) und Amantadin (einem Dopamin-Wiederaufnahmehemmer) behandelt. Leider konnte das Milwaukee-Protokoll bis heute keine signifikanten Erfolge zeigen. Bis heute bleibt die Tollwut eine Krankheit, für die keine einheitlich wirksame Behandlungsmethode existiert. Die einzige Möglichkeit, sich vor der Infektion zu schützen, ist die prophylaktische Impfung, sowie eine fachmännisch durchgeführte Postexpositionsprophylaxe, falls der Verdacht einer Infektion besteht.
[1] Orenstein, Walter A., et al. (2017): Plotkin’s Vaccines, S. 1341, 7. Aufl. Elsevier
[2] Modrow, Susanne et al. (2021): Molekulare Virologie, S. 338 4. Aufl. Spektrum akademischer Verlag
